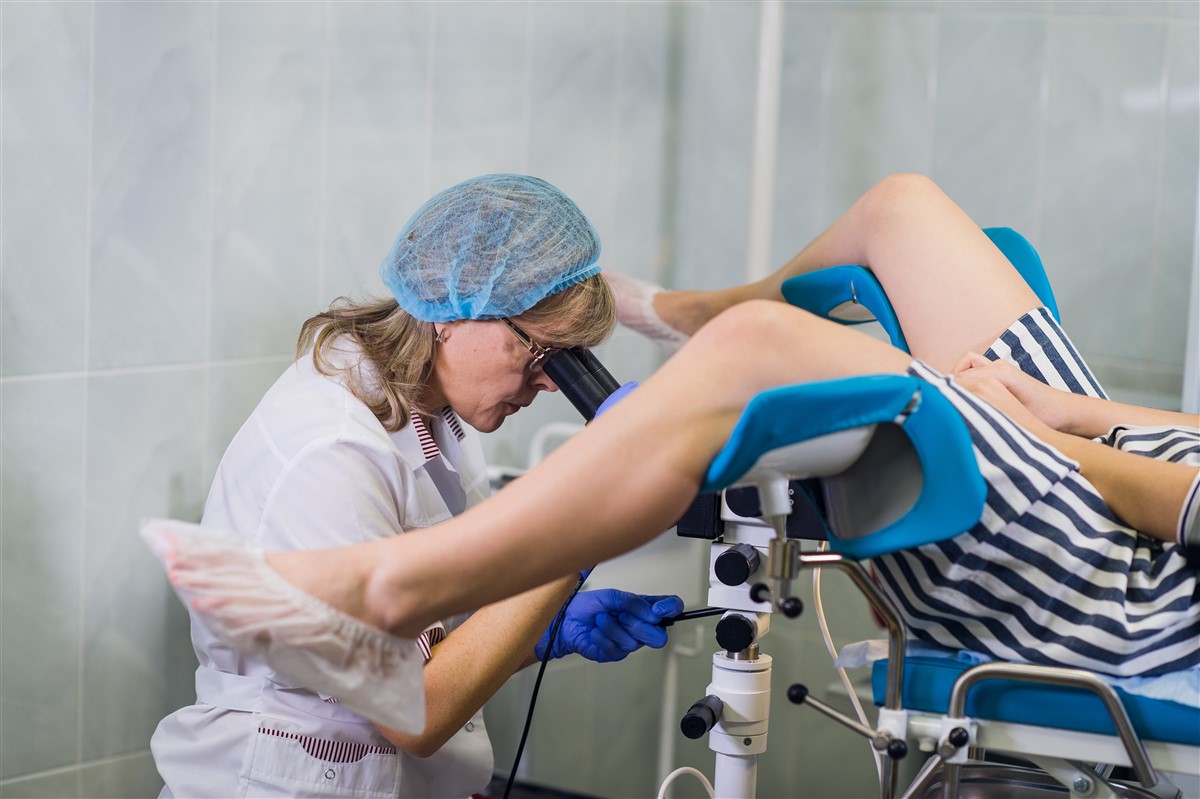
Comment les colposcopes révolutionnent le diagnostic en gynécologie ?
L’évolution technologique a laissé une empreinte indélébile dans le paysage des soins de santé, particulièrement dans le domaine de la gynécologie. Les colposcopes, ces appareils portables de surveillance à distance, sont la preuve vivante de cette transformation. Alors, comment ces appareils révolutionnent-ils le diagnostic en gynécologie ?
Les colposcopes : une avancée majeure dans le domaine de la gynécologie
Les colposcopes ont transformé le domaine de la gynécologie en apportant une précision remarquable dans le diagnostic et le traitement des affections gynécologiques. Ces appareils, couplés à l’intelligence artificielle, permettent une détection précoce des anomalies, améliorant ainsi les résultats des patients.
Les colposcopes offrent aux gynécologues la capacité de visualiser avec précision les zones d’intérêt, permettant une analyse plus détaillée et une meilleure prise de décision. Ainsi, ils contribuent à garantir une meilleure qualité de soins pour les femmes, renforçant leur confiance envers les prestataires de soins de santé.
L’apport de l’intelligence artificielle dans le diagnostic gynécologique
L’intelligence artificielle (IA) est un autre facteur clé qui a modifié le paysage des soins gynécologiques. Les modèles d’IA, alimentés par des données historiques et des données en temps réel, améliorent la précision du diagnostic et du traitement. En outre, l’IA, en tandem avec les colposcopes, permet une surveillance à distance, ce qui est particulièrement bénéfique pour les patients vivant dans des zones à faible densité médicale.
De plus, l’IA facilite également la conduite d’essais cliniques en gynécologie, en fournissant aux chercheurs des outils pour analyser de grandes quantités de données et en fournissant des insights qui peuvent conduire à des solutions innovantes pour améliorer la santé des femmes.
La portée des colposcopes dans les soins de santé des femmes
Grâce aux colposcopes, les professionnels de santé peuvent désormais offrir aux femmes des soins plus personnalisés et précis. Ces appareils ont rendu possible un suivi régulier et une détection précoce de nombreuses affections gynécologiques, réduisant ainsi le risque de complications.
Dans le même temps, les colposcopes offrent aux femmes un plus grand contrôle sur leur propre santé. Ils peuvent être utilisés à la maison, ce qui permet aux femmes de surveiller leur santé en toute intimité et d’obtenir des informations précises qu’elles peuvent partager avec leur gynécologue.
Vers un futur amélioré pour la santé des femmes
Les colposcopes ont sans aucun doute aidé à façonner un nouveau paysage dans les soins de santé pour les femmes. Grâce à leur précision et à leur facilité d’utilisation, ces appareils ont révolutionné le domaine de la gynécologie. Ils ont permis de réaliser des diagnostics plus précis, d’offrir des traitements plus efficaces et de garantir des résultats plus positifs pour les patients.
Il est intéressant d’examiner les nuances de cette avancée technologique et de son impact sur la santé des femmes. Les colposcopes, avec l’aide de l’IA, continuent à évoluer et à apporter des améliorations significatives dans le domaine des soins de santé. Ils ouvrent la voie à des diagnostics plus précis et à un meilleur traitement des affections gynécologiques.
En conclusion, les colposcopes ont changé la façon dont les gynécologues diagnostiquent et traitent les affections gynécologiques. Ils ont rendu les soins de santé plus accessibles, plus personnalisables et plus efficaces. Et avec l’évolution constante de la technologie, le potentiel de ces appareils pour améliorer la santé des femmes est immense.
Intégration, sécurité et adoption : des enjeux cruciaux
Au-delà de la performance diagnostique, l’efficacité des colposcopes dépendra de leur capacité à s’inscrire dans un écosystème numérique sécurisé et interopérable. L’intégration fluide avec le dossier médical électronique, la gestion des flux d’images et des métadonnées, ainsi que la sécurité des données (chiffrement, anonymisation, traçabilité) sont autant de points déterminants pour la confiance des équipes cliniques et des patientes. Des protocoles de validation, des procédures d’assurance qualité et des cycles de maintenance des capteurs doivent être définis pour garantir la reproductibilité des mesures et la conformité aux cadres réglementaires. La mise en place d’audits, d’indices de performance et de tests de calibration réguliers assurera la robustesse des dispositifs et facilitera la validation clinique multicentrique nécessaire à leur adoption à large échelle.
Par ailleurs, l’appropriation professionnelle et l’acceptabilité sociétale exigent des efforts sur la formation continue, l’ergonomie des interfaces et l’accompagnement des parcours de télémédecine. L’évaluation économique (analyse coût-efficacité, modèles de remboursement) et la surveillance post-commercialisation (pharmacovigilance numérique, rapports d’incident) orienteront les décisions d’investissement et les politiques de santé. Enfin, l’exploitation des données pour des modèles prédictifs et des algorithmes d’apprentissage profond nécessitera une gouvernance transparente et éthique afin d’éviter les biais et de préserver la qualité des soins. Pour approfondir ces aspects opérationnels et réglementaires, consultez cet article à lire sur pharmazenconseil.fr.
Perspectives techniques et impacts cliniques complémentaires
Au‑delà de la simple visualisation, l’avenir du diagnostic gynécologique passera par des avancées en imagerie spectrale et par l’intégration de capteurs hyperspectraux capables de détecter des signatures tissulaires subtiles non perceptibles en lumière blanche. Ces technologies, couplées à des pipelines de segmentation d’image et à l’utilisation de jeux de données augmentés ou de données synthétiques, favoriseront la standardisation des examens et la réduction de la variabilité inter‑opérateurs. L’intégration de signaux issus de la cytopathologie et de biomarqueurs moléculaires permettra de développer des scores composites de risque, améliorant la sensibilité et la spécificité des algorithmes d’aide à la décision. Par ailleurs, des approches d’apprentissage fédéré offriront une voie pour entraîner des modèles robustes tout en préservant la confidentialité des données cliniques.
Sur le plan opérationnel, il faudra accompagner ces innovations par des modules de support décisionnel cliniquement validés, des parcours de validation en routine et des outils pédagogiques destinés aux patientes pour garantir un vrai consentement éclairé. La création d’indicateurs de qualité centrés sur la reproductibilité des mesures et sur l’explicabilité des recommandations algorithmiques renforcera l’acceptabilité médicale et sociale. Enfin, penser ces dispositifs comme des briques d’un continuum de soins — depuis le dépistage organisé jusqu’au suivi post‑thérapeutique — facilitera leur intégration dans les stratégies de santé publique et leur adoption par les réseaux de soins primaires et spécialisés.
Déploiement opérationnel et durabilité : éléments complémentaires
Pour compléter les dimensions cliniques et réglementaires déjà évoquées, il est crucial d’aborder les défis techniques liés au déploiement à grande échelle : optimisation des flux réseaux, maintenance prédictive et durabilité, et réduction de l’empreinte environnementale des dispositifs. L’intégration d’edge computing permet de traiter et d’annoter localement des séquences d’imagerie lourdes, diminuant la latence et la dépendance au cloud tout en facilitant des mécanismes de compression sans perte et de streaming adaptatif pour préserver la qualité diagnostique. Parallèlement, la mise en place d’indicateurs de performance des capteurs et de systèmes de monitoring à distance favorise la maintenance prédictive des composants optiques et électroniques, prolongeant leur durée de vie et limitant les pannes en milieu clinique. Ces approches techniques doivent s’accompagner d’une gestion responsable du cycle de vie — évaluations environnementales, audits énergétiques et stratégies de recyclage — afin d’assurer une trajectoire d’innovation soutenable.
Sur le plan des usages, l’optimisation des parcours patient et des équipes passe par l’automatisation mesurée des tâches répétitives, la standardisation des formats d’échange sémantique et l’amélioration de l’usabilité des interfaces cliniques. Des bancs de simulation et des modules de formation immersive permettent d’homogénéiser les compétences, tandis que des mécanismes d’audit énergétique et de traçabilité logistique garantissent une chaîne d’approvisionnement plus résiliente. Enfin, l’attention portée à l’accessibilité numérique, aux supports multilingues et à l’inclusion garantit que ces innovations bénéficient à l’ensemble des patientes, réduisant les inégalités d’accès aux soins. L’articulation entre optimisation technologique, responsabilité environnementale et équité d’accès constitue ainsi une voie complémentaire essentielle pour maximiser l’impact positif des dispositifs de diagnostic en gynécologie.
Renforcer la recherche translationnelle et l’engagement des patientes
Pour compléter les avancées technologiques, il est essentiel d’ouvrir de nouveaux chantiers autour de la valorisation des données cliniques et de l’amélioration des protocoles de prélèvement. Le développement de biobanques dédiées à l’imagerie gynécologique, couplées à des bases annotées intégrant des paramètres cliniques, biologiques et images multispectrales, permettra d’alimenter des études longitudinales robustes. L’ajout d’analyses du microbiome vaginal et de phénotypes immunologiques locaux aux jeux de données favorisera l’émergence de signatures diagnostiques multimodales et de scores de risque plus fins. Parallèlement, la mise au point de procédures standardisées pour la biopsie dirigée et pour la calibration colorimétrique des systèmes d’acquisition garantira la comparabilité intercentre des mesures et facilitera la création de référentiels de qualité.
Sur le plan opérationnel, associer les patientes au design des études et aux parcours de suivi renforce l’adhésion et la qualité des données rapportées. Des outils numériques de retour d’information — tableaux de bord simplifiés, traces de suivi et modules éducatifs — peuvent améliorer l’autosurveillance et le dialogue clinique. Enfin, l’élaboration d’indicateurs de performance dédiés à la recherche translationnelle (taux d’inclusion, complétude des métadonnées, qualité des acquisitions) aidera à prioriser les actions d’amélioration continue.
Compléments méthodologiques : radiomique, mesures patient‑centrées et seuils décisionnels
En complément des aspects techniques et organisationnels déjà abordés, il est utile d’explorer des approches quantitatives qui renforcent la valeur clinique des examens. L’exploitation de la radiomique, du phénotypage numérique et des mesures rapportées par les patientes ouvre une voie pour extraire des « descripteurs » numériques à partir des images et les corréler avec des scores cliniques et biologiques. La mise en place d’un pipeline robuste implique une calibration radiométrique, des méthodes de normalisation intercentre et une métrologie de l’incertitude pour garantir la comparabilité des traits radiomiques. Sur le plan statistique, l’intégration de modèles probabilistes (par exemple des algorithmes bayésiens) permet de définir des valeurs seuils décisionnelles et des intervalles de confiance exploitables en consultation, favorisant une stratification du risque plus fine et des parcours de suivi personnalisés. L’utilisation conjointe d’indicateurs de performance robustes (courbes ROC, AUC, mais aussi métriques de calibration et courbes de décision) facilitera l’évaluation comparative des outils et la sélection des candidats pour des études cliniques prospectives.
Parallèlement, il est essentiel d’inclure des instruments de qualité de vie et des mesures rapportées sur la santé (PROMs) dans les protocoles d’évaluation pour mesurer l’impact réel des innovations sur le vécu des patientes. Le déploiement d’un système de surveillance des dérives de modèle, assorti d’un monitoring continu des métriques et d’audits périodiques, garantit la sécurité et la pertinence clinique au fil du temps. Des essais d’implémentation pragmatiques (essais d’implémentation ou cohortes d’acceptabilité) permettront d’ajuster les seuils opérationnels et les interfaces utilisateurs avant généralisation.